Révolution : Protéger la Mémoire lors de la Radiothérapie
Imaginez un instant : vous ou l'un de vos proches combat un cancer du cerveau, la radiothérapie sauve potentiellement votre vie... mais au prix d'une mémoire qui s'effrite, d'une concentration qui s'envole et d'une qualité de vie durablement altérée. Ce dilemme cruel touche des milliers de patients chaque année. Pourtant, une avancée scientifique récente pourrait bien changer la donne de manière spectaculaire.
Des chercheurs de l'Université de Californie à Irvine et de l'Université du Queensland ont publié une étude qui fait naître un réel espoir. En ciblant un récepteur immunitaire précis, ils ont réussi à protéger les fonctions cognitives des souris soumises à une irradiation crânienne, sans pour autant diminuer l'efficacité anti-tumorale du traitement. Une prouesse qui pourrait transformer le quotidien des survivants du cancer cérébral.
Une avancée contre les effets secondaires cognitifs de la radiothérapie
La radiothérapie reste l'un des piliers du traitement des tumeurs cérébrales comme le glioblastome ou l'astrocytome. Malheureusement, elle entraîne souvent des troubles cognitifs graves et durables : jusqu'à 70 % des patients survivants rapportent des difficultés de mémoire, d'attention et de résolution de problèmes. Ces effets, qualifiés de déclin cognitif induit par la radiothérapie, résultent principalement d'une inflammation chronique du cerveau.
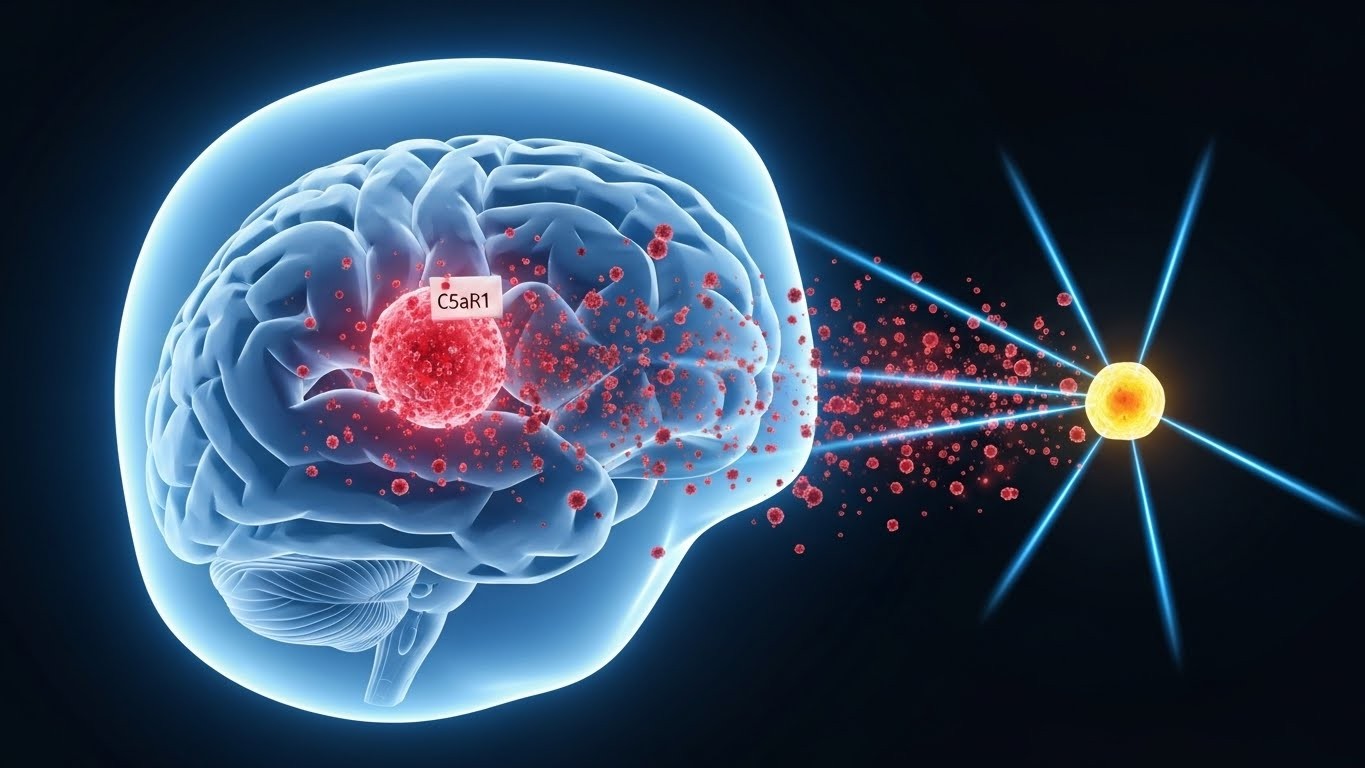
Le coupable ? Le système du complément, cette partie de notre immunité innée qui, lorsqu'elle est hyperactivée, attaque les tissus sains, en particulier les connexions neuronales. Les chercheurs se sont donc focalisés sur une molécule clé de cette cascade : le récepteur C5aR1, qui reçoit le signal de la protéine inflammatoire C5a.
« Nous avons identifié une voie ciblée pour protéger le cerveau des effets délétères de la radiothérapie crânienne, un traitement standard qui cause souvent un déclin cognitif irréversible. »
– Munjal Acharya, PhD, auteur principal de l'étude
En bloquant ce récepteur, l'équipe a observé des résultats impressionnants chez la souris, ouvrant la porte à une nouvelle stratégie thérapeutique.
Deux approches qui convergent vers la même protection
Les scientifiques ont employé deux méthodes complémentaires pour valider leur hypothèse. D'abord, des souris génétiquement modifiées dépourvues du gène codant pour C5aR1 (knockout). Ensuite, des souris normales traitées avec le PMX205, un inhibiteur oral capable de traverser la barrière hémato-encéphalique.
Après avoir reçu une dose importante d'irradiation (équivalente à celle utilisée en clinique), les animaux ont été soumis à différents tests comportementaux : reconnaissance d'objets, mémoire spatiale et extinction de la peur. Les résultats sont éloquents : les souris protégées (knockout ou traitées) conservent des performances cognitives normales, tandis que les témoins irradiés sans protection montrent un déclin marqué.
Sur le plan biologique, on observe une réduction drastique de l'activation des microglies (les macrophages du cerveau), une diminution de l'astrogliose, une préservation des protéines synaptiques et une modulation favorable de l'expression génique (augmentation des gènes neuroprotecteurs, diminution des marqueurs inflammatoires).
Le point crucial : pas de compromis sur l'efficacité anti-cancéreuse
L'une des grandes forces de cette approche réside dans son innocuité vis-à-vis du traitement principal. Chez les souris porteuses de tumeurs cérébrales (modèles syngéniques de glioblastome), le blocage de C5aR1 n'a pas altéré la capacité de la radiothérapie à réduire le volume tumoral. Au contraire, dans certains cas, les résultats ont même semblé légèrement améliorés.
Les animaux traités conservent donc à la fois une meilleure survie liée au cancer et une cognition intacte. Un double bénéfice qui rend cette stratégie particulièrement attractive pour une application clinique future.
- Protection cognitive complète malgré irradiation
- Pas d'interférence avec l'effet anti-tumoral
- Réduction massive de l'inflammation neurodégénérative
- Préservation de l'intégrité synaptique
Ces éléments combinés font de l'inhibition de C5aR1 une piste sérieuse pour améliorer la qualité de vie post-traitement.
PMX205 : déjà testé chez l'humain, un atout majeur
Le composé PMX205 n'est pas une molécule sortie de nulle part. Ce petit inhibiteur du récepteur C5aR1 a déjà franchi les premières étapes de la sécurité clinique. Des essais de phase I chez des volontaires sains et chez des patients atteints de sclérose latérale amyotrophique (SLA) ont démontré une excellente tolérance, sans effets secondaires majeurs ni risque infectieux accru.
Administrable par voie orale et capable de pénétrer efficacement dans le cerveau, il présente un profil pharmacologique idéal pour une utilisation en oncologie. Les chercheurs prévoient désormais des études plus avancées : combinaison avec la chimiothérapie (comme le temozolomide), utilisation prophylactique, et tests sur des modèles dérivés de patients humains.
« Nous envisageons d'étudier le PMX205 en prévention et en association avec la radiothérapie et la chimiothérapie, dans des modèles plus proches de la clinique. »
– Munjal Acharya, chercheur principal
Des limites à garder en tête, mais un optimisme mesuré
Comme toute étude préclinique, celle-ci présente certaines limites. Les chercheurs ont utilisé une dose unique élevée d'irradiation, alors que les protocoles humains fractionnent généralement les doses. Il faudra donc confirmer l'efficacité dans des schémas fractionnés.
De plus, les tests cognitifs chez la souris ne reproduisent pas parfaitement la complexité de la cognition humaine. Enfin, des études à long terme seront indispensables pour évaluer les effets prolongés et les interactions potentielles avec d'autres traitements.
Malgré ces réserves raisonnables, l'approche apparaît très prometteuse. Le fait que l'inhibiteur ait déjà un profil de sécurité établi chez l'homme accélère considérablement le chemin vers des essais cliniques chez les patients atteints de cancer cérébral.
Vers une médecine plus humaine en oncologie cérébrale
Cette découverte illustre parfaitement comment une meilleure compréhension des mécanismes immunitaires peut transformer des traitements anciens et efficaces mais toxiques. En protégeant sélectivement le cerveau sain tout en laissant la radiothérapie détruire la tumeur, on passe d'une logique de « survie à tout prix » à celle d'une survie avec qualité de vie préservée.
Pour les patients et leurs familles, c'est une lueur d'espoir concrète. Pour la communauté scientifique, c'est la preuve que cibler finement l'inflammation neurodégénérative peut ouvrir de nouvelles voies thérapeutiques dans de nombreux domaines : cancers, maladies neurodégénératives, traumatismes crâniens...
L'aventure ne fait que commencer. Si les prochaines étapes confirment ces résultats chez l'humain, l'inhibition de C5aR1 pourrait devenir un standard de soin adjuvant dans la prise en charge des tumeurs cérébrales. Un petit récepteur, une grande espérance.
Et vous, que pensez-vous de cette avancée ? Partagez votre avis en commentaires !